蔡刚荣登《科学》!中国科大首次在亚纳米尺度上描绘DNA修复关键蛋白的三维结构
近日,中国科学技术大学生命学院蔡刚与南京农业大学王伟武合作,首次在亚纳米尺度上描绘出DNA修复的关键蛋白ATR激酶的三维结构,从而可以了解这种蛋白对DNA损伤的响应机制,该成果发表在12月1日的顶级学术期刊《科学》上。
细胞通过不断分裂来修补和替换受损组织,每一次的分裂都需要重新“复印”一次细胞的“遗传蓝图”。随着DNA的复制,“错印”不可避免地发生了,这种损伤若是置之不理,就会导致细胞的死亡。
一旦感受到DNA损伤的迹象,一种叫做ATR激酶的蛋白质就会活化细胞固有修复系统。作为机体负责维持细胞稳态的六大蛋白质激酶之一,ATR蛋白负责启动细胞对DNA损伤和复制压力的修复。当这个家族的蛋白质发现了问题,比如DNA损伤,ATR就会激活修复损伤所必须的下游信号通路。
视频:科学家以“近原子分辨率”描绘DNA修复关键组分的结构
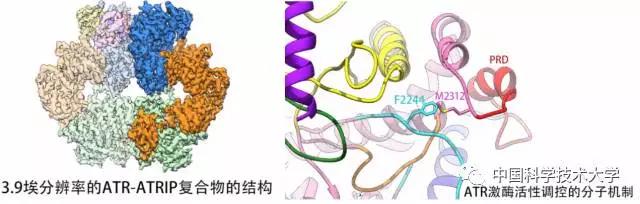
通过ATR-ATRIP复合物启动细胞DNA损伤应答 /王国燕、陈磊制图
解析ATR激酶的活化机制一直是生命科学领域的核心问题之一。这个问题包括ATR激酶是如何响应DNA损伤的,又是如何被活化的。
论文通讯作者、中国科学技术大学生命学院蔡刚教授介绍说,他的团队利用电子显微镜,在3.9埃即0.39纳米的精度下构建了酵母中的Mec1-Ddc2复合物的原子模型。这种复合物,对应于人体内的ATR蛋白和它的信号通路伴侣蛋白ATRIP。酵母Mec1-Ddc2复合物和人类ATR-ATRIP复合物具有高度的保守性,结构相似度高。“我们相信从酵母Mec1-Ddc2复合物中获得的信息,能够帮助阐明人类ATR-ATRIP复合物的结构和分子机制。”
酵母Mec1-Ddc2复合物的三维结构 /王国燕、马燕兵制图
蔡刚(科大生命学院)同时指出,使用顶级的冷冻电子显微镜对Mec1-Ddc2复合物进行观察,可以获得近原子级别精度的三维结构,该结构已经验证并拓展了现有的关于ATR的多个发现。
高清结构揭示了ATR激酶活性调控的分子机制和关键调控位点,为研制新型ATR激酶抑制剂用于肿瘤治疗奠定了结构基础。/蔡刚课题组
蔡刚说,ATR激酶被视为潜在的癌症治疗靶点已有很长时间了。高分辨率的结构信息揭露了ATR激酶的调控位点,处于待激活状态的ATR,一旦检测到DNA损伤迹象,会迅速被激活。“阐明这些位点的调控机制,有望指导新型癌症治疗药物的开发。”
蔡刚教授和他的团队目前正在对酵母Mec1-Ddc2复合物及人类ATR-ATRIP复合体的不同激活阶段进行成像,期望开发特定性更强和效率更高的ATR抑制剂,以便探索优化癌症治疗的可能性。
生命学院蔡刚教授简介
蔡刚,教授。2001年本科毕业于安徽大学获得学士学位,2001年至2006年于中科院上海生命科学研究院攻读博士学位。2006至2010年在美国The Scripps Research Institute进行博士后研究。多年来专注于采用冷冻电镜(cryo-EM)解析真核生物转录中央控制器—“中介体”的结构和功能,研究成果先后发表于Nature, Nature Structural & Molecular Biology, Cell Research, 和Structure等国际高水平杂志上。2010年11月起任中国科学技术大学生命科学学院教授。 2011年入选教育部新世纪人才支持计划。2012年获得首届国家基金委‘优秀青年科学基金’项目。
2017-12-04 上一篇: 预告:9月24日北京校友金秋午餐会 下一篇: 2016年年检报告





 京公网安备 11010802035836号
京公网安备 11010802035836号